
Improving the Lives of Your Aging Male Patients: Considering Whether Testosterone Plays a Meaningful Role
Chair: David Greenberg, BA, MD, *Co-chair of Membership Committee, Canadian Society for the Study of the Aging Male, Toronto, ON; Member Of Executive, Department of Family & Community Medicine, St. Joseph's Health Centre, Toronto, ON.
The Prevalence of Hypogonadism among Men who Have Type 2 Diabetes and/or the Metabolic Syndrome—Is it
Clinically Relevant?
Speaker: Jeremy Gilbert, MD, FRCPC, Endocrinology and Metabolism, Sunnybrook Health Sciences Centre, Toronto, ON.
Dr. Jeremy Gilbert addressed the clinical relevance of the association between type 2 diabetes/the metabolic syndrome and hypogonadism among aging males. He described the theme as particularly worthy of attention given the increasingly epidemic status of diabetes and the metabolic syndrome, and their growing prevalence among an aging population.
Referring to a common clinical scenario of low testosterone in the presence of metabolic syndrome, Dr. Gilbert described a 55-year-old male patient complaining of tiredness, poor concentration, low libido, and muscle weakness. The patient’s metabolic state (blood pressure 140/90, waist circumference 102 cm, body mass index [BMI] 29, fasting blood sugar 6.7, cholesterol 5.7, HDL 0.9, LDL 3.5, triglycerides 2.8) corresponded to the metabolic syndrome; his total testosterone level ranked low at 9 nmol/L. How, clinically, should his T level be approached? How concerning is it?
This hypothetical case typifies the kind of patient he sees with metabolic syndrome. Dr. Gilbert emphasized the number of patients with similar health conditions: currently, 2.4 million Canadians have diabetes; additionally, an estimated 570,000 have undiagnosed type 2 diabetes. Approximately 6 million Canadians have pre-diabetes or are at high risk for developing type 2 diabetes. Within the large burden posed by these conditions, certain ethnic and age subgroups have higher levels of disease or disease risk. Currently available data may underestimate disease risk and prevalence, especially among patients of advanced age.
The estimated prevalence of hypogonadism ranges from 20–64%, depending on the study source. Testosterone levels are consistently shown to bear an inverse relationship to BMI. Dr. Gilbert cited data from several studies, including a JAMA meta-analysis of patients with diabetes showing that the prevalence of patients with hypogonadism among patients with type 2 diabetes is 2–3 times higher. The cross-sectional studies examined indicated that testosterone level was significantly lower in men with type 2 diabetes (mean difference, –76.6 ng/dL; 95% confidence interval [CI], –99.4 to –53.6), and prospective studies showed that men with higher testosterone levels (range, 449.6–605.2 ng/dL) had a 42% lower risk of type 2 diabetes (RR, 0.58; 95% CI, 0.39 to 0.87).1
Dr. Gilbert described the data supporting the association as robust. He cited a Finnish study that assessed the association of low testosterone and sex hormone–binding globulin (SHBG) with the development of the metabolic syndrome and diabetes.2 Of the 702 subjects studied (with no diabetes or metabolic syndrome at baseline) 147 developed metabolic syndrome and 57 developed diabetes over the 11-year follow-up. They found that the metabolic syndrome was 2–3 times more common among those with low testosterone. The study authors concluded that hypogonadism is an early marker for disturbances in insulin and glucose metabolism and serves as a predictor of progression to the metabolic syndrome or frank diabetes.
Dr. Gilbert also drew attention to results of the Hypogonadism in Males (HIM) study, which showed the large prevalence of hypogonadism among aging men with the metabolic syndrome.3 Researchers documented the prevalence of hypogonadism via measurements of total testosterone in men aged ≥45 years (mean age was 60.5 years) visiting primary care practices in the United States. They found an overall prevalence of 38%. Importantly, the study captured the comorbid conditions that may occur with hypogonadism in men who present to primary care: the greater the risk factors for metabolic syndrome, the more likely patients were, according to the study, to have lower testosterone.
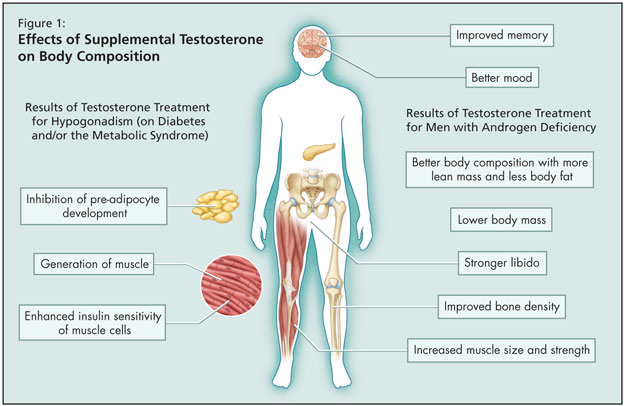
Given the strong association between the metabolic syndrome and hypogonadism, could treatment of low testosterone correct the components of the metabolic syndrome? It is known that in men with androgen deficiency, testosterone treatment results in improved memory, better mood, stronger libido, better body composition with more lean mass and less body fat, lower body mass, and increased muscle size and strength, as well as improved bone density (Figure 1). But what are the implications of treating hypogonadism for diabetes and/or the metabolic syndrome? The data show that supplemental testosterone leads to generation of muscle, inhibits development of pre-adipocytes, and enhances insulin sensitivity of muscle cells. Dr. Gilbert cited two studies that have examined the correlation.
He mentioned a double-blind placebo-controlled crossover study in 24 hypogonadal men with type 2 diabetes that found testosterone replacement therapy significantly improved insulin resistance and improved glycemic control.4 Additionally, a second study published in early 2009 of 95 middle-aged to older hypogonadal men showed improvement of markers of the metabolic syndrome upon testosterone administration.5
When clinicians encounter a patient in their clinical practice paralleling the symptom profile of the 55-year-old patient with metabolic syndrome of Dr. Gilbert’s example, he recommended that testosterone levels be checked. Those in primary care and internal medicine should consider testosterone more often, he stated.
Given that it has been demonstrated that the odds of having metabolic syndrome are 2–3 times greater in those with hypogonadism, testosterone replacement may be useful clinically to improve parameters of the metabolic syndrome. However, Dr. Gilbert advised that more evidence from large controlled trials is necessary to confirm the clinical utility of testosterone therapy in heart outcomes (e.g., CVD prevention) associated with metabolic syndrome in the context of hypogonadism.
References
-
Ding EL, Song Y, Malik VS, et al. Sex differences of endogenous sex hormones and risk of type 2 diabetes: a systematic review and meta-analysis. JAMA 2006;295:1288–99.
-
Laaksonen DE, Niskanen L, Punnonen K, et al. Testosterone and sex hormone-binding globulin predict the metabolic syndrome and diabetes in middle-aged men. Diabetes Care 2004;27:1036–41.
-
Mulligan T, Frick MF, Zuraw QC, et al. Prevalence of hypogonadism in males aged at least 45 years: the HIM study. Int J Clin Pract 2006;60:762–9.
-
Kapoor D, Goodwin E, Channer KS, et al. Testosterone replacement therapy improves insulin resistance, glycaemic control, visceral adiposity and hypercholesterolaemia in hypogonadal men with type 2 diabetes. Eur J Endocrinol 2006;154:899–906.
-
Haider A, Gooren LJ, Padungtod P, et al. Concurrent improvement of the metabolic syndrome and lower urinary tract symptoms upon normalisation of plasma testosterone levels in hypogonadal elderly men. Andrologia 2009;41:7–13.
Sponsored by an unrestricted educational grant from Solvay Pharma Inc.