
La sénescence cellulaire
Conférencière : Sharon Marr, B.Sc., M.D., FRCP(C), M.Ed., Université McMaster & Centre des Sciences de la Santé d’Hamilton, Division de médecine gériatrique et de médecine interne générale, Hamilton, ON.
Dans son allocution prononcée devant les stagiaires en gériatrie, la Dre Marr s’est attachée à promouvoir une meilleure compréhension des changements cellulaires accompagnant le vieillissement, à clarifier les concepts de base concernant l’ADN et l’expression des gènes affectant la sénescence, à exposer en détail les mécanismes de défense cellulaire et à faire le point sur les implications cli-niques de la sénescence cellulaire.
Étant donné les augmentations prévues de la population des personnes âgées et le fardeau des maladies liées au vieillissement sur le système de soins de santé, une meilleure compréhension de la biologie du vieillissement est très importante pour les cliniciens. La Dre Marr a distingué le concept de durée de vie, définie comme une durée constante maximale de la vie d’un membre d’une espèce dans des conditions optimales de vie (p. ex., 120 ans), de celui d’es-pérance de vie, qui est l’estimation statistique du nombre d’années de vie qu’on peut espérer vivre à un âge donné.
Les facteurs de la durée de la vie en rapport avec les changements cellulaires liés au vieillissement comprennent des facteurs génétiques et environnementaux (p. ex. l’impact qu’ont sur la durée de vie, la restriction calorique, les dommages/ mutations de l’ADN, le rayonnement ionisant, le stress oxydatif à l’intérieur ou à l’extérieur de la cellule), ainsi que les stress psychologiques et métaboliques, comme le diabète.
La sénescence cellulaire (du latin senex, âgé) est fondamentalement comprise comme un processus induit par l’évolution de la constitution génétique d’un organisme. Le concept englobe tous les processus biologiques d’un organisme vivant qui vieillit. La sénescence induit des modifications fonctionnelles dans les cellules qui ont un « potentiel réplicatif complet » et dans celles qui sont en phase post-mitotique.
Elle a abordé l’importance du phénomène de Hayflick dans la sénescence cellulaire. La limite fait référence à la découverte que les cellules humaines dérivées de tissus embryonnaires ne peuvent se diviser qu’un nombre de fois li-mité en culture. Le Dr Hayflick et ses collègues, qui travaillaient sur des fibroblastes diploïdes humains (un type cellulaire présent dans le tissu conjonctif), ont trouvé qu’ils cessent de croître in vitro après un nombre limité de doublements de population (~ 50 réplications), un phénomène dénommé « sénescence réplicative », qui sert de modèle à la compréhension du vieillissement humain.
La Dre Marr a parlé de l’importance du raccourcissement des télomères. Les télomères sont des sections non codantes situées aux extrémités des chromosomes ; ils protègent ainsi contre la fusion des extrémités chromosomiques. Chez les vertébrés, ils sont composés de séquences répétitives de TTAGGG. À chaque réplication, notre ADN se raccourcit un peu.
Le raccourcissement des télomères est maintenant considéré comme le mécanisme causal principal de la sénescence réplicative.1 Une autre découverte capitale a aussi été celle de James Watson qui a montré que l’ADN polymérase ne pouvait pas complètement synthétiser l’extrémité 3’ de l’ADN linéaire. À partir de l’idée de réplications incomplètes des extrémités chromosomiques, Alexey Olovnikov a observé que les cellules somatiques humaines ne pouvaient pas complètement réparer le raccourcissement chromosomique au cours de la réplication de l’ADN, et que cette dégradation se produisait chaque fois. Olovnikov a suggéré que le problème de la réplication des extrémités occasionnerait un raccourcissement du télomère au cours de chaque réplication et que ce mécanisme serait la cause de la sénescence réplicative. Néanmoins, d’autres recherches ont montré que l’activité de la télomérase peut aussi allonger les télomères et corriger l’érosion normale du télomère.
Les recherches génétiques ont également ouvert de nouvelles perspectives sur le vieillissement humain et la sénescence cellulaire. Les syndromes de vieillissement accéléré ont mis en évidence le rôle des gènes, comme dans le syndrome de Werner, une anomalie du gène WRN, situé sur le bras court du chromosome 8. L’anomalie est directement causée par un mauvais entretien du télomère, qui devient plus court que la normale, ce qui affecte la réplication de l’ADN.
Des études menées chez l’animal portant sur l’érosion et le raccourcissement du télomère ont suggéré que ce raccourcissement était corrélé au vieillissement, et que l’âge chronologique n’était pas un prédicteur de l’espérance de vie.2
En général, a résumé la Dre Marr, la sénescence réplicative est associée à la perte progressive de la réplication du brin d’ADN télomérique aux extrémités des molécules d’ADN, et les télomères deviennent plus courts à chaque division cellulaire. On a observé que certaines protéines (p. ex., la b-galactosidase et les protéines suppresseurs de tumeurs) sont protectrices contre certains cancers (p53, p21, et p16) et sont sujettes à une régulation positive. Le dommage génétique et le stress oxydatif contribuent aussi au raccourcissement télomérique par une atteinte directe de l’ADN.
La Dre Marr a alors parlé des effets de l’âge sur les organes, qui vieillissent à des vitesses différentes, puis est passée aux baisses du système immunitaire avec l’âge. Le système immunitaire inné, première ligne de défense contre l’infection, comprend les neutrophiles, les macrophages, les cellules tueuses naturelles, ainsi que les cytokines et les chimiokines. Par exemple, les neutrophiles sont sujets à des réductions, liées à l’âge, de la phagocytose, de l’explosion oxydative et de l’activité bactéricide, alors que les macrophages perdent en vieillissant l’efficacité de phagocytose, de l’explosion oxydative et de l’expression des CMH de classe II. Comme autre changement important, il y a aussi le renforcement d’un état pro-inflammatoire avec une augmentation des cytokines. Un tel état peut accroître ou stimuler le développement de maladies comme l’ostéoporose, la neurodégénérescence et l’athérosclérose coronarienne, et il génère des produits de dégradation difficiles à éliminer.
Pour ce qui est de l’altération de l’immunité adaptative, dans les cellules T, l’involution thymique accélère la perte progressive des cellules T naïves, et il y a une diminution de la capacité de traiter de nouveaux pathogènes, entre autres effets délétères. Les principales modifications au niveau des cellules B comprennent la réduction des cellules B naïves, la baisse de production d’immunoglobuline (IgM>IgG), l’augmentation des autoanticorps et la réduction de l’affinité de liaison des anticorps.
Malgré une immunogénicité réduite, il y des données clairement en faveur de certaines vaccinations chez les personnes âgées. Par exemple, avec le nouveau vaccin contre la varicelle et le zona on observe une réduction de 61 % de l’herpès zoster et de 66 % de la névralgie post-herpétique.3
Quant aux implications de la sénescence cellulaire sur les maladies cardiovasculaires et leur traitement, les cellules endothéliales coronariennes et les cellules musculaires lisses vieillissent avec nous, a fait remarquer la Dre Marr en citant un travail de coloration de dépôts de protéines qui était positive pour la b-galactosidase (associée à la sénescence). D’autres études portant sur l’altération des télomères ont mis en évidence une augmentation de la prolifération des myocytes cardiaques, une hypertrophie des myocytes et une insuffisance cardiaque, ce qui suggère que le raccourcissement des télomères avec l’âge peut aussi contribuer à l’insuffisance cardiaque chez les humains.4
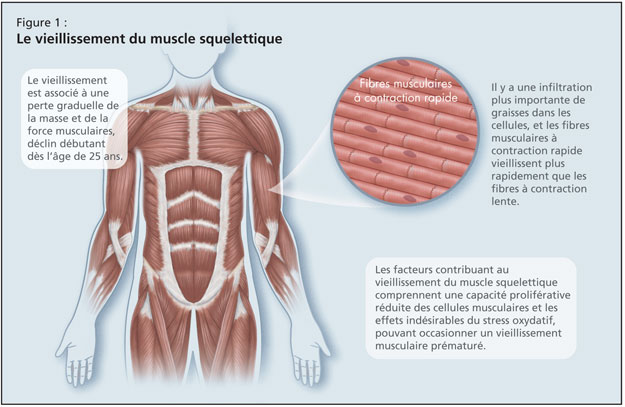
Le vieillissement du muscle squelettique est également préoccupant, et elle a rappelé à son auditoire que le vieillissement est associé à une perte graduelle de la masse et de la force musculaires, déclin débutant dès l’âge de 25 ans (Figure 1). Il y a une infiltration plus importante de graisses dans les cellules, et les fibres musculaires à contraction rapide vieillissent plus rapidement que les fibres à contraction lente.5 Les facteurs contribuant au vieillissement du muscle squelettique comprennent une capacité proliférative réduite des cellules musculaires et les effets indésirables du stress oxydatif, pouvant occasionner un vieillissement musculaire prématuré. De plus, il y a les effets bien connus du vieillissement osseux, avec une réduction de la formation osseuse et une réduction de l’entretien et de la réparation du cartilage.
Pour terminer par une réflexion sur les implications cliniques du vieillissement cellulaire, la Dre Marr a signalé le risque accru d’infection, et l’augmentation du fardeau de la maladie liée à une immunogénicité plus faible ; cependant, un espoir réside dans de nouvelles recherches sur la prévention de nombreuses formes de cancers de la vieillesse (p. ex., par répression de la télomérase ectopique ou l’inhibition de la télomérase) et dans l’importance de plus en plus reconnue d’éviter les stress environnementaux et de promouvoir des habitudes de vie saines.
Références :
-
Shawi M, Autexier C. Telomerase, senescence and ageing. Mech Age Devel 2008;129:3–10.
-
Bize P, Criscuolo F, Metcalfe NB, et al. Telomere dynamics rather than age predict life expectancy in the wild. Proc Biol Sci 2009;276:1679-83.
-
Oxman MN, Levin MJ, Johnson GR, et al. A vaccine to prevent herpes zoster and postherpetic neuralgia in older adults. N Engl J Med 2005;352:2271–84.
-
Leri A, Franco S, Zacheo A, et al. Ablation of telomerase and telomere loss leads to cardiac dilatation and heart failure associated with p53 upregulation. EMBO J 2003;22:131–9.
-
Lexell J. Human aging, muscle mass, and fiber type composition. J Gerontol A Biol Sci Med Sci 1995;50 Spec No:11–6.