
Le vieillissement normal : immunologie et hématologie
Conférencier : Shabbir M.H. Alibhai, M.D., M.Sc., FRCP(C), Division de la médecine gériatrique, Université de Toronto; Chercheur scientifique, Société canadienne du cancer, Toronto, ON
Le Dr Shabbir Alibhai a adressé les changements des systèmes immunologique et hématologique qui se produisent avec le vieillissement et leurs implications cliniques.
Il a souligné la pertinence de l’homéosténose, défini par GE Taffett comme une constriction progressive des réserves homéostatiques qui se produit avec le vieillissement (c. à d., une habilité réduite, dans le temps, de faire face aux perturbations et stress externes). Tous les systèmes vieillissent et subissent un dérèglement avec une amplification des processus indésirables. Il a précisé que les effets de l’âge sur les paramètres de la santé varient significativement et augmentent avec le vieillissement. De plus, le rôle des facteurs comportementaux et environnementaux sur la santé n’est pas bien compris. Il a de même averti que le défi d’identifier le meilleur modèle du vieillissement normal chez les humains ne devrait pas être sous-estimé, et non plus le rôle que joue le biais de sélection dans les publications d’études du vieillissement.
Le Dr Alibhai a noté que son intérêt porte surtout sur les lignées cellulaires de lymphocytes B et lymphocytes T qui interagissent significativement dans le système immunologique. Le Dr Alibhai a affirmé que beaucoup de ce qui est connu dans ce domaine provient de recherches in vitro approfondies. Il est nettement plus difficile en immunologie d’obtenir des recherches in vivo; la manutention in vitro est problématique du fait que les manipulations peuvent causer une altération et une perturbation des fonctions cellulaires. Certains résultats in vitro ont une pertinence clinique limitée ou des implications non vérifiées. Finalement, les résultats provenant du modèle animal sont variablement dupliqués dans les études chez les humains.
Le système immunitaire est composé de l’immunité innée et de l’immunité adaptative ou acquise (divisées en composantes cellulaires et humorales). Le Dr Alibhai a noté l’artificialité de la distinction étant donné la complexité de la relation entre les lymphocytes B et lymphocytes T en présence d’infection et d’autres syndromes du dérèglement immunitaire.
L’immunité innée est la première ligne de défense. L’immunité innée fournit une défense rapide, mais incomplète contre les attaques étrangères jusqu’à ce que la réponse immunitaire acquise qui est plus lente, mais plus définitive se développe.
Les cellules dendritiques sont d’une grande importance dans le déclenchement de la réponse immunitaire et comme cellules présentant l’antigène; elles font parvenir des signaux d’activation aux lymphocytes T. Des études chez des sujets humains ont généralement démontré une aptitude de présentation de l’antigène équivalente chez les plus vieux et les plus jeunes, aussi bien qu’une aptitude équivalente à induire la prolifération des lymphocytes T.
Il a ensuite parlé du rôle des macrophages, cellules qui sont activées tôt dans la défense immunitaire. Certaines preuves démontrent une fonction détériorée avec l’âge, ce qui porte à conséquence étant donné leur rôle dans la phagocytose et la destruction intracellulaire, et comme cellules présentant l’antigène pour le reste du corps. Avec l’âge, l’activation non spécifique est plus commune, cependant il y a une capacité réduite de la production du facteur de nécrose tumorale (TNF), l’interleukine (IL)-1, et l’oxyde nitrique (essentiel à l’inhibition de la croissance de tumeurs et à la stimulation des défenses immunitaires). Le Dr Alibhai a décrit leur fonctionnement comme « hyperactif »; leur dysfonctionnement peut contribuer à un ralentissement de la cicatrisation des plaies.
Le Dr Alibhai a ensuite détaillé le rôle des cellules tueuses naturelles (NK) qui détruisent spontanément les cellules ciblées sans activation. Il est incertain si le nombre de cellules NK ou leur activité changent avec l’âge. Afin d’activer les cellules NK au maximum, un taux plus élevé d’interféron a serait peut-être re-quis.
Finalement, le système complémentaire est important pour le fonctionnement du système immunitaire inné. Le Dr Alibhai l’a décrit comme un système enzymatique qui catalyse d’autres réactions par la cytolyse, activant ainsi la cascade inflammatoire. Le système complémentaire exemplifie l’homéosténose, puisque lorsqu’un animal plus vieux est inoculé, la voie complémentaire ne se déclenche pas d’une efficacité maximale.
Le système complémentaire se compose de 20 protéines plasmatiques qui interagissent entre elles et qui constituent un système enzymatique qui défend contre les microorganismes par cytolyse, opsonisation et par activation de l’inflammation. Certaines composantes du complément sont légèrement plus élevées avec le vieillissement, mais les taux de complément n’augmentent pas avec les infections bactériennes chez les aînés et par conséquent la réponse immunitaire à l’infection est atténuée.
Portant son attention à l’immunité adaptative, le Dr Alibhai a décrit les composantes principales : les lymphocytes B (provenant de la moelle osseuse) et les lymphocytes T (provenant du thymus). Ils reconnaissent les corps étrangers par reconnaissance peptidique. Le thymus est l’endroit principal pour le développement des lymphocytes T; 95 % des thymocytes sont éliminés in situ ou par apoptose. Le dérèglement augmente avec le vieillissement : l’involution thymique commence à la naissance et subit une involution importante de 90 % par l’âge de 60, au-delà duquel les hormones thymiques ne sont plus détectables dans le sérum.
La défectuosité de la plus haute importance avec le vieillissement est la perte de la fonction des lymphocytes T auxiliaires (causé par une baisse de la production d’anticorps, une capacité réduite d’expansion sous attaque et une différentiation incomplète). La réponse proliférative des lymphocytes T aux lectines mitogéniques est atténuée; d’autres exemples de sa dérégulation comprennent une manifestation de ca-ractéristiques aberrantes avec le vieillissement. Chez les aînés, les lymphocytes T, une fois activés, sont plus aptes à initier l’apoptose et sont plus lentement remplacés.
Portant son attention aux lymphocytes B, le Dr Alibhai a déclaré que leur plus important rôle est de produire des anticorps comme partie de la réponse humorale. Avec le vieillissement, cette réponse est affaiblie de façon qualitative et quantitative. Les aînés ont une réponse atténuée à l’immunisation avec une plus faible production d’anticorps. Les anticorps naturels déclinent avec l’âge dû à la perte de lymphocytes B et la fréquence de la réponse antigénique des lymphocytes B diminue — le nombre de cellules est non seulement moindre, mais dans le temps jusqu’à 30 % deviennent non fonctionnelles. D’autres importants changements comprennent une augmentation de la production d’IgG non spécifique; de plus, les lymphocytes B peuvent être chroniquement activés et présenter d’autres formes de dérèglements. Il semble y avoir une augmentation de l’activité auto-immune avec le vieillissement, avec une fréquence plus élevée d’auto-anticorps contre des antigènes spécifiques et non spécifiques aux organes. La signification clinique de ces auto-anticorps demeure contestée.
De plus, le Dr Alibhai a parlé des changements immunologiques du système de la muqueuse. Soulignant la lacune de bonnes données, il a mentionné que l’intégrité de la muqueuse semble se dégrader avec l’âge et il y a possibilité de défectuosités de la production locale d’anticorps.
Par rapport à une allergénicité modifiée, il semblerait que les réactions d’hypersensibilité causées par l’IgE sont moins fréquentes avec le vieillissement, mais ceci demeure hypothétique. La production sérique de l’IgE décline avec l’âge et entre autres formes de dérèglements on retrouve une déficience de la production d’IL-4.
L’âge apporte des dérèglements plus fréquents du système de cytokine — une série complexe de protéines pro-inflammatoires et anti-inflammatoires qui interagissent entre elles et aident à régulariser le système immunitaire — avec des changements importants mettant en jeu l’IL-6 (Figure 1). L’augmentation de l’IL-6 associée à l’âge est une importante perturbation des cytokines, a affirmé le Dr Alibhai, et peut accompagner une inflammation chronique; ceci mène à une résorption de l’os, peut jouer un rôle dans la maladie d’Alzheimer et peut causer une morta-lité excessive à moyen terme. La production d’IL-1 diminue avec l’âge et la production et la faculté de réponse de l’IL-2 sont atténuées. Puisque les cytokines n’agissent pas indépendamment, il a noté qu’il est difficile de déterminer quelles modifications des cytokines sont importantes. Au fil du temps, la réponse des lymphocytes T à l’infection est plus élevée que celle des lymphocytes B. On ne peut attribuer tous les changements au vieillissement en soi; la maladie subclinique et les facteurs environnementaux y jouent sans doute un rôle.
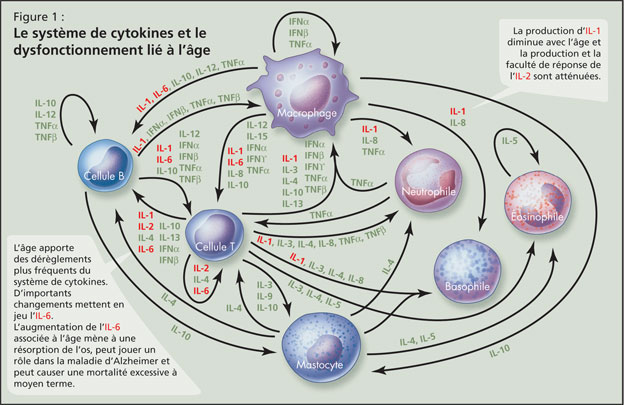
La conséquence clinique chez les aînés est la prédisposition à l’infection, mais pas à une déficience immunitaire manifeste. Il y a un risque croissant de réactivation d’infections latentes tels que le zona et les infections mycobactériennes. Ces risques s’aggravent avec la maladie et la malnutrition. De plus, les vaccinations sont moins efficaces et il y a un risque croissant d’infection parasitaire.
Les options de traitement pour inverser les changements du vieillissement sont limitées en raison d’un manque d’études de haute qualité, à long terme, et puisque l’innocuité et l’effica-cité des agents thérapeutiques prometteurs ne sont pas clairement établies. De nouvelles preuves suggèrent que la mélatonine serait potentiellement de valeur pour augmenter la production d’anticorps et l’activité des lymphocytes T, et pourrait peut-être stimuler la production de l’IL-2. D’autres données suggèrent qu’une alimentation nutritionnelle mo-difiée a des effets positifs sur la santé (p. ex., une amélioration de l’immunité par une plus grande consommation d’acides gras polyinsaturés et de vitamine E); de plus, une modification au calendrier d’immunisation (p. ex. de plus nombreuses doses du vaccin d’hépatite B chez les aînés) démontre des bénéfices, mais de plus grandes études sont requises.
La prochaine section de la présentation a porté sur les changements du système hématologique avec l’âge. Habituellement, la concentration de la majorité des éléments du sang ne changent pas avec l’âge. L’anémie devient cependant beaucoup plus commune avec l’âge, mais n’est pas fondamentalement liée à l’âge (les réserves de fer du corps augmentent avec l’âge); elle serait plutôt attribuable à la maladie ou à d’autres facteurs (p. ex., légères carences alimentaires). Il est possible que le taux d’hémoglobine baisse légèrement avec l’âge quoique ceci demeure controversé. Plus important encore, la moelle osseuse âgée ne peut répondre rapidement à une grave perte de sang. Il faut donc plus de temps pour corriger une anémie aigüe en fabriquant de nouveaux érythrocytes. Le Dr Alibhai a rappelé à l’auditoire que le nombre du total des leucocytes ne change pas avec l’âge, mais la réponse aux stress est atténuée. Le nombre de neutrophiles et de monocytes ne change pas avec l’âge, cependant le nombre de lymphocytes baisse légèrement. Paradoxalement, en présence d’une infection bactérienne, il y a des baisses du nombre et du taux de prolifération des neutrophiles précurseurs, partiellement à cause du dérèglement des cytokines. Les neutrophiles vieillissants ont une capacité réduite de migration au site de blessure et de génération d’oxydants antimicrobiens en réponse à une attaque. Les lymphocytes vieillissants sont plus vulnérables aux effets néfastes de la radiation.
Avec l’âge, l’hypercoagulabilité et une augmentation de la viscosité des érythrocytes sont possibles, mais les données sont incertaines.
Les implications cliniques de ces changements hématologiques comprennent une prédisposition plus élevée chez les aînés de développer et maintenir une anémie en réponse à un saignement. Il a réitéré que l’anémie n’est pas occasionnée par le vieillissement et requiert des investigations. Quant aux dangers de l’anémie, il a préconisé que les physiciens surveillent son association avec la fatigue, une guérison plus lente d’une incapacité AQV, des fonctions exécutives détériorées, des symptômes de dépression, un taux d’hospitalisation croissant et un taux de mortalité croissant. Que ce soit en partie cause ou corrélation est toujours sous investigation.
Une autre implication clinique veut que les individus qui subissent une suppression de la moelle osseuse (p. ex. avec la chimiothérapie), soient habituellement recommandés un facteur de croissance hématopoïétique (p. ex., facteur de croissance des granulocytes) comme prophylaxie de neutropénie dans un milieu oncologique.
En conclusion, il a souligné que les indices hématologiques ne changent pas avec l’âge et que les tests non effractifs pour l’anémie (ferritine, B12, acide folique des GR, etc.) sont aussi sensibles et spécifiques que chez les individus plus jeunes. Le Dr Alibhai a attiré l’attention sur les preuves que l’hyperréticulocytose se détériore avec le vieillissement, que la réponse réticulocyte à une administration d’érythropoïétine est atténuée et que d’autres réserves de la moelle osseuse baissent en réponse à une demande croissante.